维立志博创新双抗LBL-034获美国FDA孤儿药认定,用于治疗多发性骨髓瘤
| 后台-插件-广告管理-内容页头部广告(手机) |
南京2024年11月6日 /美通社/ -- 11月1日,南京维立志博生物科技股份有限公司(以下简称"维立志博")自主研发、拥有全球知识产权的1类新药LBL-034获美国食品药品监督管理局(FDA)授予的孤儿药资格认定,用于治疗多发...
南京2024年11月6日 /美通社/ -- 11月1日,南京维立志博生物科技股份有限公司(以下简称"维立志博")自主研发、拥有全球知识产权的1类新药LBL-034获美国食品药品监督管理局(FDA)授予的孤儿药资格认定,用于治疗多发性骨髓瘤(MM)。
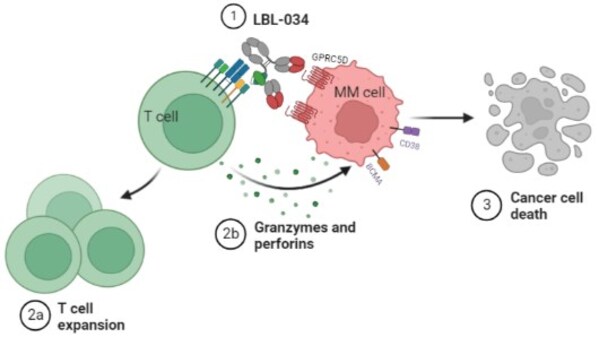
LBL-034是应用维立志博自主研发并具有知识产权的CD3双抗技术平台"LeadsBodyTM"开发的新一代靶向GPRC5D及CD3的人源化双特异性T细胞衔接抗体,是全球第三个进入临床阶段的靶向GPRC5D的CD3 T细胞连接器。LBL-034仅在GPRC5D+细胞存在时选择性地与T细胞结合,从而在GPRC5D表达的肿瘤微环境中条件性地激活T细胞。在高、中及低GPRC5D表达的细胞中,LBL-034始终表现出优异的靶向肿瘤细胞杀伤作用,以及强大的剂量依赖性抗肿瘤活性,显示有成为同类抗肿瘤药最佳选择的潜力。
LBL-034于2023年7月分别在中国和美国获准开展临床研究,并于2023年11月在中国启动了在复发/难治性多发性骨髓瘤(RRMM)患者中开放标签、多中心、剂量递增/扩展的I/II期研究。这项由北京大学人民医院路瑾教授牵头、多中心参与的临床研究展现了良好的安全性和有效性,并将在2024年第66届美国血液学会年会(ASH)展示其初步临床数据。
孤儿药资格认定是FDA对维立志博LBL-034在MM治疗领域显著潜力的高度认可。孤儿药资格认定是FDA为鼓励开发罕见病治疗药物而设立的,可为新药开发提供一系列的激励措施,包括但不限于:(1)临床试验费用的税收抵免;(2)FDA对临床研究各阶段的特别指导;(3)免除新药注册申请费用;(4)上市后享有7年的市场独占权。这将有助于加快推进LBL-034在全球的后续临床开发和上市进程。
维立志博首席医学官蔡胜利博士表示:"很高兴我们在开发新药造福罕见病患者的道路上取得积极进展。MM目前仍是无法治愈的恶性肿瘤,随着多线用药,复发的间隙会越来越短,最终演变为RRMM,严重威胁患者的生命健康,开发新的、更有效的治疗方案迫在眉睫。LBL-034采用了独特的分子设计,非临床研究结果显示其具有良好的抗肿瘤效果及安全性。我们将加速LBL-034的临床开发进程,力求早日将安全、有效的治疗方案带给全球MM患者。"
维立志博创始人、董事长、CEO康小强博士表示:"LBL-034是维立志博首个获得FDA孤儿药认定的产品,标志着我们在这条充满挑战但又意义非凡的道路上迈出了成功的第一步,我们也将以此为契机,进一步优化管线布局,拓宽在生物医药领域的探索边界,为更多未被满足的医药需求提供创新解决方案。"
| 后台-插件-广告管理-内容页尾部广告(手机) |